Los vínculos entre la respuesta inmune, la clínica y las alternativas terapéuticas .
Dra. Silvina Villar
Instituto de Inmunología Clínica y Experimental de Rosario dependiente del CONICET y de la Facultad de Ciencias Médicas de la Universidad Nacional de Rosario.
Introducción
En noviembre de 2019 era inimaginable haber pensado que 30 días más tarde, el mundo entraría en un estado de alerta inminente frente a lo que después fue declarada como una pandemia por la Organización Mundial de la Salud (OMS) el 11 de marzo de 2020 (1). En apenas contados meses, la enfermedad por coronavirus 2019 (COVID-19) con inicio en la ciudad de Wuhan (China) se extiende por todo el mundo.
Antes de 2019, solo se habían informado seis coronavirus, cuatro de ellos con afección leve en seres humanos (HKU1, NL63, OC43 y E229) capaces de causar el 10 al 20% de las infecciones respiratorias en todo el mundo y presentes en todos los continentes (2–6), dos con episodios de coronavirus emergentes (7).
El primero, en el año 2002, el virus del Síndrome Respiratorio Agudo Severo (SARS), tuvo muy poco impacto en la morbilidad y mortalidad global (8); y el segundo, en el año 2015, el Síndrome de las Vas Respiratorias del Medio Oriente (MERS)-coronavirus, que permaneció localizado en Arabia Saudita, con una pequeña epidemia de infecciones principalmente nosocomiales en Corea del Sur (9). Este sí tuvo una mortalidad mucho mayor.
Finalmente, el SARS-CoV-2, el nuevo coronavirus que apareció en diciembre de 2019, se ha expandido y al momento de escribir este artículo ha afectado a más de 1,3 millones de personas y responsable de 76.000 muertes en todo el mundo.
Por el poco tiempo transcurrido aún no se dispone de niveles de evidencia sólidos. Aun así, existen datos que permiten dar una visión en cuanto a las diferentes respuestas del sistema inmune en función del estado de inflamación en pacientes sintomáticos (severos y graves) y su asociación con los glucocorticoides, los diferentes sistemas de detección y potenciales vacunas en vías de desarrollo.
La infección COVID-19 en términos de citocinas e inmunosupresión
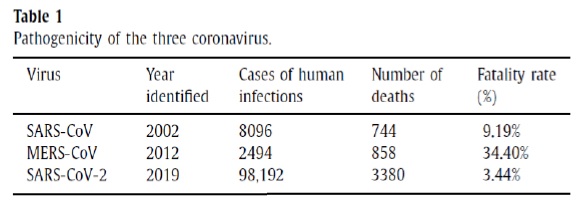
Zhang y coautores (10), han informado que la mortalidad para el SARS-CoV-2 es de 3,44% respecto al 9,19% del SARS-CoV, pero sin dudas el número de casos para SARS-CoV2 es superior respecto a los coronavirus ya conocidos, de lo que se desprende que el SARS-CoV-2 es más contagioso pero menos mortal que el SARS-CoV (tabla 1, copia fiel del trabajo original).
Según informes recientes de datos que se van sumando día tras día, la mayoría de los pacientes con COVID-19 tienen un período de incubación de 3 a 7 días, mientras que un 85 % permanece asintomático y con potencial de trasmitir la enfermedad, el 55 % presenta síntomas leves a moderados como fiebre, tos y fatiga entre los más comunes, mientras que la congestión nasal, la secreción y la diarrea solo se observan en una pequeña parte de los pacientes. Los casos graves aproximadamente un 10% pueden progresar rápidamente a síndrome de dificultad respiratoria aguda, shock séptico y muerte en un 5% de los casos.
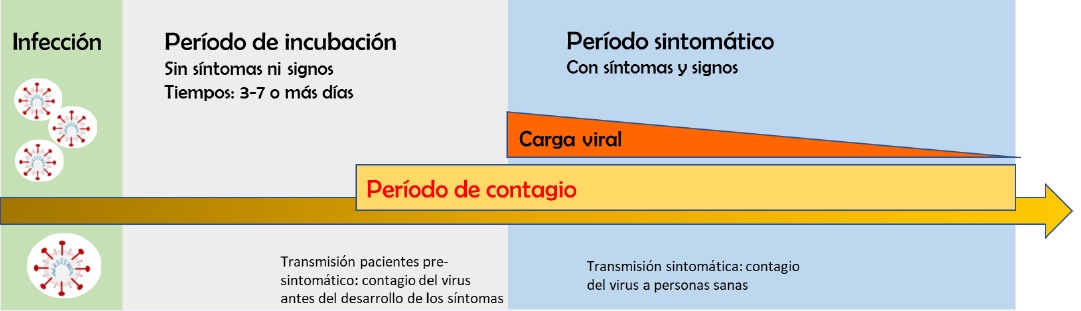
Figura 1: esquema de los diferentes períodos durante el curso de la infección COVIR-19
Para las pruebas de laboratorio, se informó que la mayoría de los pacientes presentaron linfopenia y proteína C-reactivo elevada (11). Sin embargo, las características clínicas y de laboratorio no se distinguen fácilmente de la neumonía inducida por la infección con otros patógenos comunes del tracto respiratorio.
The Lancet en su artículo “COVID-19: consider cytokine storm syndromes and immunosuppression”, afirma que la insuficiencia respiratoria por síndrome de dificultad respiratoria aguda (SDRA) es la principal causa de mortalidad (12), la misma transcurre con una respuesta inflamatoria sistémica no controlada con alta liberación de citocinas proinflamatorias denominada “tormenta de citocinas” las que inicialmente son generadas por macrófagos y células efectoras activadas por el virus (13).
Resultados publicados recientemente indican que pacients severos con COVID-19 presentan linfopenia con bajo recuento de TCD4+ y CD8+ , además hay una diminución de células T CD4+ IFN-?+, es decir, no solo hay una disminución de células efectoras de linaje T, sino que éstas parecen estar agotadas.
El perfil de citocinas que se desencadena se asocia con la gravedad de la enfermedad COVID-19, dentro de las cuales se destaca el aumento de interleucina (IL) -2R, IL-6, IL-10, IL-12, IL-7, factor de necrosis tumoral (FNT-α), interferón (IFN-γ, IFN-α),factor estimulante de colonia granulocítica (G-CSF), proteína quimioatrayente de monocitos 1 (MCP1), proteína inflamatoria de macrófagos 1-α (MIP1-α) (14), lo que probablemente conduce a la célula T CD4+ a un perfil T helper-1 activada (Th1).
Sin embargo, la infección COVID-19 también inicia una mayor secreción de citocinas T-helper-2 (Th2), entre ellas IL-4 e IL-10, que suprimen la inflamación y permitiría el desarrollo de una respuesta humoral con la consiguiente producción de anticuerpos neutralizantes, esto difiere de la infección por SARS-CoV. A pesar de estos datos, es de destacar que se necesitan más estudios para caracterizar los perfiles inmunes Th1 y Th2 en respuestas en la infección COVID-19.
| El aumento de la carga viral y paralelamente un retraso en la respuesta de IFN tipo I con acumulación de monocitos y macrófagos inflamatorios llevaría al fracaso de la respuesta inmune para controlar la infección, impulsando en el organismo un estado inflamatorio severo, que lejos de eliminar al virus genera una respuesta inapropiada para el hospedero. |
En consecuencia, los hallazgos de múltiples estudios en humanos y animales indican que la inmunosupresión de corticosteroides (tanto inhalada como sistémica) altera la inducción de respuestas antivirales de IFN-tipo I a una variedad de virus respiratorios (15,16) efectos que probablemente también ocurran en el contexto de COVID-19.
Sin embargo, se ha demostrado que la supresión del IFN-tipo I con anticuerpos monoclonales como Tofacitinib u otros mediadores (p. ej., Interleucina 6) también podría promover la infección bacteriana secundaria y complicar aún más el curso de la enfermedad (16). La decisión de inmunosuprimir farmacológicamente a un paciente críticamente enfermo con COVID-19 sigue siendo difícil. Los posibles efectos beneficiosos de reducir la inflamación deben sopesarse cuidadosamente contra el potencial de deterioro perjudicial de la inmunidad antimicrobiana.
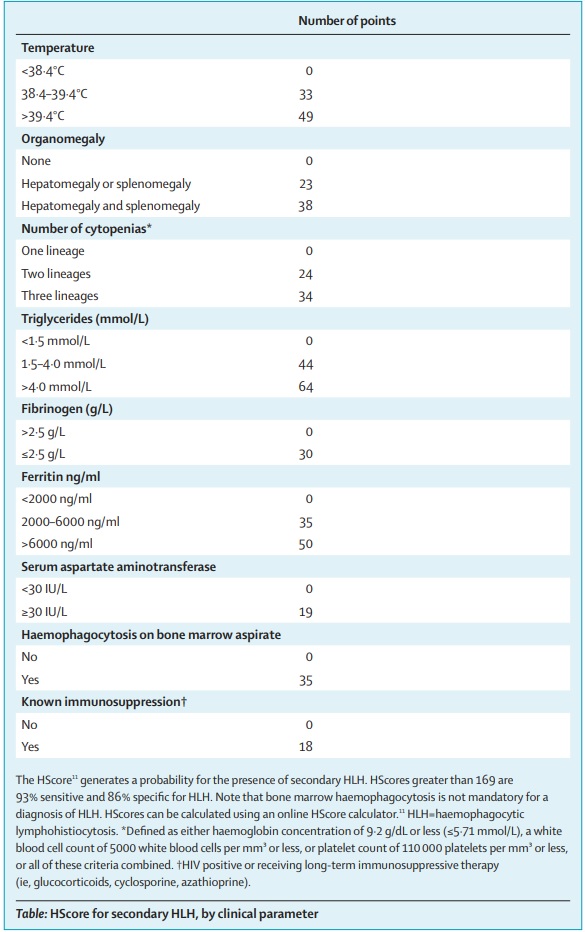
Tabla 2: Published Online March 13, 2020 https://doi.org/10.1016/ S0140-6736(20)30628-0
Actualmente, el tratamiento de COVID-19 es de apoyo, y la insuficiencia respiratoria causada por el síndrome de dificultad respiratoria aguda (SDRA) es la principal causa de mortalidad. Hoy se plantea que en algunos pacientes críticos se desarrolla una linfohistiocitosis hemofagocítica secundaria (sHLH) (10), caracterizado por ser un síndrome inflamatorio poco reconocido que se define por un aumento excesivo de citoquinas que lleva a la muerte por fallo multiorgánico.
En adultos, la sHLH se desencadena con mayor frecuencia por infecciones virales (17) y ocurre en 3,7–4,3% de los casos de sepsis (18). Las características de la sHLH incluyen fiebre constante, citopenias, hiperferritinemia, disminución de la función citolítica de los linfocitos T CD8+ y células NK y un perfil de citocinas que se asemeja con la gravedad de la enfermedad COVID-19.
En este punto, es posible que todos los pacientes con COVID-19 severos sean evaluados con pruebas de laboratorio que determinen si la capacidad citotóxica y la expresión de perforina de las células NK y de los linfocitos T CD8+ están disminuidas, así como también los niveles de ferritina y el HScore11 (tabla 2) para identificar el subgrupo de pacientes para quienes la inmunosupresión podría mejorar la mortalidad. Las opciones terapéuticas podrían incluir esteroides, inmunoglobulina intravenosa, bloqueo selectivo de citocinas (p. Ej., Anakinra o tocilizumab) e inhibición de JAK.
Respuesta humoral: dinámica en el título de anticuerpo durante el curso de la infección por COVID-19
Los anticuerpos, son el producto de una respuesta inmune adaptativa humoral
En las infecciones víricas los anticuerpos más eficaces son aquellos que tienen una alta afinidad, de manera que su unión al virus bloquea la entrada a las células e impida la propagación de una célula a otra. Esta protección es crítica para eliminar los viriones durante la infección y se consigue a través de:
1) Neutralización directa de patógenos.
2) Opsonización para promover la eliminación por células fagocíticas.
3) Activación del sistema del complemento.
De esta manera, la inmunidad humoral inducida es capaz de actuar cuando el virus se encuentra fuera de la célula; cuando el virus entra a la célula, comienza a replicarse en su interior y se vuelven inaccesible a los anticuerpos.
La respuesta de anticuerpos en pacientes infectados con el emergente SARS-CoV-2 sigue siendo en gran medida desconocida. Nuevos estudios están mostrando avances de pruebas serológicas en la detección de anticuerpos que podrían ser de información clínica vital durante el curso de la infección por SARS-CoV-2 (19).
Zaho y col. realizaron un estudio donde incluyeron un total de 173 pacientes con infección por SARS-CoV-2, durante el tiempo de hospitalización se tomaron muestras de plasma (535), en estas muestras se analizaron anticuerpos totales (Ab), IgM e IgG contra SARS-CoV-2 mediante ELISA.
Los resultados publicados demostraron una respuesta típica de anticuerpos a la infección viral aguda, como era de esperar, primero se detectó el anticuerpo total, seguido de IgM e IgG, con una tasa de seroconversión para Ab, IgM e IgG del 93,1%, 82,7% y 64,7%, respectivamente. Todos los pacientes fueron seroconvertidos, excepto 12 pacientes que podría deberse a que solo hubo una muestra y la misma fue recolectada en la etapa temprana de la enfermedad (antes de los 13 días de inicio).
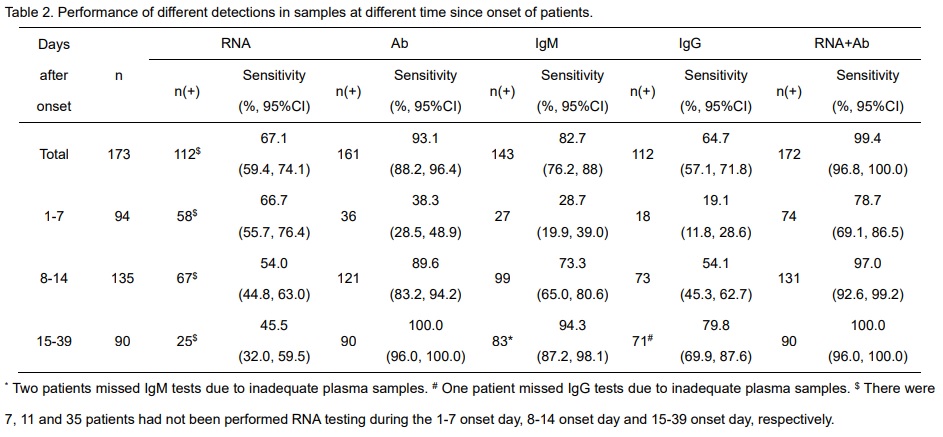
Tabla 3: detección de carga vira (RT-PCR) y anticuerpos (ELISA) desde el comienzo de la infección por CoV-2. Extraído de la publicación https://doi.org/10.1101/2020.03.02.20030189.
La presencia de anticuerpos fue <40% entre los pacientes dentro de 1° semana desde el inicio, y aumentó después de 15 días del inicio de la infección al 100.0% (Ab), 94.3% (IgM) y 79.8% (IgG). Se destaca que además del valor de diagnóstico de la prueba de Ab, hay una fuerte correlación positiva entre la gravedad clínica y el título de anticuerpos desde la segunda semana después del inicio de la enfermedad. En el estudio, no pudieron evaluar la persistencia de los anticuerpos a lo largo del tiempo, por falta de seguimiento de los pacientes con posterioridad de la enfermedad.
En un trabajo publicado el 6 de abril por Guo y col (20) se realizaron determinaciones de carga viral (realtime
PCR) y dosaje de anticuerpos IgM, IgA e IgG simultáneamente, los resultados demuestran muestran
que los anticuerpos IgM e IgA comienzan a aumentar a partir de 5 días, mientras que la IgG se detecta a los 10 días después del inicio de los síntomas, con una tasa positiva de 85.4%, 92.7% y 77.9%
respectivamente (Figura 2 A).
Como se muestra en la figura 2 B, el punto de inflexión de las curvas de detección de anticuerpos y de carga viral (PCR) es al día 7, a ese día, cuando se combina el ensayo ELISA IgM con RT-PCR la tasa de detección positiva aumenta significativamente (98,6%) para cada paciente en comparación con una sola prueba de qPCR (51,9%).
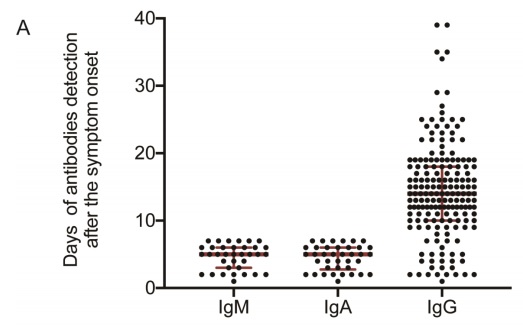
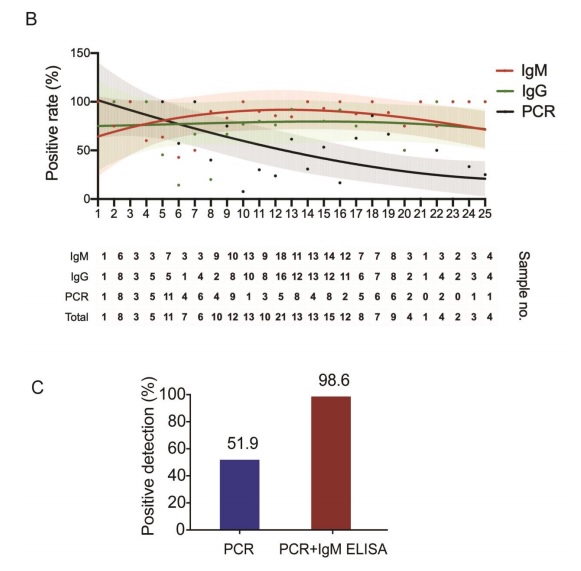
Figura 2: Comparación entre la detección de Ac y carga viral. Extraído de https://academic.oup.com/cid/advance-articleabstract/doi/10.1093/cid/ciaa310/
Los resultados demuestran la dinámica de los anticuerpos con el progreso de la enfermedad, cabe destacar, que, si bien la prueba de ELISA realizada tiene una buena especificidad en personas sanas, la reactividad cruzada entre los diferentes coronavirus no pudo ser evaluada con precisión. Estos hallazgos proporcionan una fuerte evidencia de la aplicación rutinaria de ensayos de anticuerpos serológicos en el diagnóstico y manejo clínico de la enfermedad. En este sentido, apoyamos que en Argentina que varios grupos de investigación que pertenecen a CONICET y a las Universidades Públicas estén aunando fuerzas en este campo.
En sintonía con lo expuesto, si se pudieran realizar las determinaciones de carga viral y dosaje de anticuerpos IgM e IgG simultáneamente en un mismo paciente, los resultados podrían interpretarse de la siguiente manera:
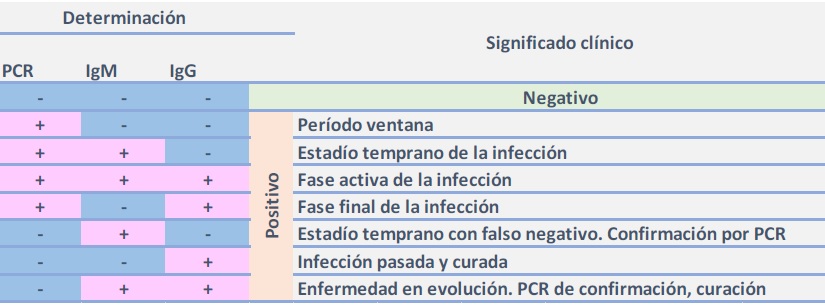
El diagnóstico preciso de la RT-PCR
Es indiscutible que el diagnóstico temprano y preciso de la infección por SARS-CoV-2 es importante para proporcionar un tratamiento adecuado a los pacientes y limitar la propagación del virus en la sociedad.
Actualmente, la detección de ARN viral basada en la reacción de real time-PCR es casi la única forma de confirmar el diagnóstico de infección por SARS-CoV-2 en la práctica.
Por otro lado, se conoce que muchos casos fuertemente vinculados epidemiológicamente a la exposición al SARS-CoV-2 fueron negativos para las pruebas de búsqueda de ARN viral por RT-PCR en hisopos de garganta o nasofaríngeos; por lo que esta técnica arroja un riesgo insignificante falso negativo.
Es de destacar que el rendimiento de la RT-PCR depende de muchos factores, como los tipos de muestra, el tiempo en la cinética de eliminación del virus, las diferentes etapas de la infección en los pacientes, la habilidad de la recolección de muestras y la calidad y consistencia de los ensayos de PCR que se utilizan.
La reacción en cadena de la polimerasa (RT-PCR) se considera una prueba “gold standard” para el diagnóstico molecular de infecciones virales y bacterianas con alta sensibilidad y especificidad21. Este método, más allá de sus falsos negativos, da ventajas respecto al tiempo de detección si se compara con la detección de anticuerpos. Esto puede observarse en la tabla 1, donde se demuestra que la presencia de ARN viral fue del 66.7% (58/87) en las muestras recolectadas antes del día 7, tiempo en el cual la detección de anticuerpos es baja, y de un 45.5% (25/55) durante los días 15-39, momento en el que el título de anticuerpos aumenta.
En nuestro país, hasta la fecha, se están realizado muchos esfuerzos en el desarrollo para mejorar la detección viral de CoV-2 como de los anticuerpos que esta infección desencadena. Para el sistema científico, el desarrollo de nuevas tecnologías y métodos más eficientes, óptimos y a gran escala es un desafío muy grande.
En este sentido, la combinación de detecciones de ARN y anticuerpos son métodos complementarios. Mientras que el primero corre con la ventaja de dar una respuesta rápida, con alto rendimiento y posibilidad de evaluar carga viral, en el segundo, los anticuerpos pueden dar una respuesta de valor clínico si se asocia con la severidad de la enfermedad.
El presente y el pasado de los sueros de convalecientes
Algo que no se puede negar es que hay una necesidad urgente para un tratamiento efectivo de COVID-19. Aquí se abre un nuevo capítulo entre terapias ya conocidas para otras patologías y las nuevas terapias en desarrollo incluyendo antivirales y vacunas. Las vacunas pueden formularse con virus completo, virus atenuados, vacunas de subunidad y vacunas de ácidos nucleicos (tanto ADN como ARNm). Actualmente hay varias vacunas en desarrollo que llevará algún tiempo, al menos un año.
Entre las diferentes terapias que se plantean está la plasmaféresis, ésta se basa en poder obtener anticuerpos neutralizantes a títulos elevados obtenidos a partir de pacientes convalecientes, es decir, de aquellos que padecieron la enfermedad y que al momento se encuentran recuperados. Esta estrategia fue desarrollada en Junín por el Dr Julio Maiztegui, para reducir la mortalidad de un 30% a un 3% de la fiebre hemorrágica Argentina.
Al día de hoy, esta terapéutica parece prometedora, sin embargo, hay varios puntos de desconocimiento. Estudios realizados sobre Dengue han definido un aumento de los anticuerpos ADE (Antibody-Dependent Enhancement) que lleva a una amplificación de la infección dependiente de anticuerpos (22). Otros aspectos, son saber si los propios anticuerpos podrían generar una citotoxicidad dependiente de anticuerpos y fagocitosis, qué título de anticuerpo es necesario, cuánto volumen, qué dosis y en qué momento de la infección conviene aplicarlo.
A medida que los países intensifican los esfuerzos para conseguir una cura, prevenir o retrasar la propagación de COVID-19, el mundo debe ser responsable y solidario en tomar las medidas adecuadas para contener y mitigar esta pandemia, este esfuerzo se construye día a día. La comunidad de la salud, tiene una tarea difícil, debe prepararse para esta oleada de pacientes potencialmente abrumadora y optimizar los flujos de trabajo, por adelantado, para un diagnóstico y aislamiento rápidos, manejo clínico y prevención de infecciones.
En nuestro caso, los investigadores debemos abordar preguntas clave sobre lo que sigue siendo una enfermedad poco conocida. La colaboración a nivel local, regional, nacional e internacional, con un enfoque en la investigación de alta calidad, la práctica basada en la evidencia, el intercambio de datos y recursos, y la integridad ética frente a desafíos sin precedentes, será clave para el éxito de estos esfuerzos.
- La autora: Dra. Silvina Villar, Instituto de Inmunología Clínica y Experimental de Rosario dependiente del CONICET y de la Facultad de Medicina de la Universidad Nacional de Rosario.
- Agradecimiento: Agradezco al Dr. Oscar Bottasso del IDICER-CONICET, Facultad de Ciencias Médicas de la Universidad Nacional de Rosario por la corrección y los aportes a este trabajo.
- Este trabajo fue realizado con datos bibliográficos documentados hasta la fecha de su publicación (ver referencias bibliográficas).
- Crédito de la imagen: Nick Woolridge / Biomedical Communications
